
El flúor es un elemento químico de número atómico 9, que pertenece al grupo de los halógenos en la Tabla Periódica. Su símbolo es una F y es el elemento más electronegativo de la Tabla Periódica y es muy reactivo. También es uno de los elementos más pequeños por su radio atómico. El flúor diatómico en condiciones normales es un gas corrosivo y muy tóxico ,de color amarillo claro, fuertemente oxidante y en disolución acuosa se presenta en forma de ión fluoruro.
Etimología : Del latín , fluo, que significa fluir
Descubridor: Moissan en el año 1886
Información del Flúor
Símbolo: F
Número atómico: 9
Peso atómico: 18,998403 u
Grupo: 17 o grupo VII A – Halógenos
Periodo: 2
Bloque: p – elementos representativos
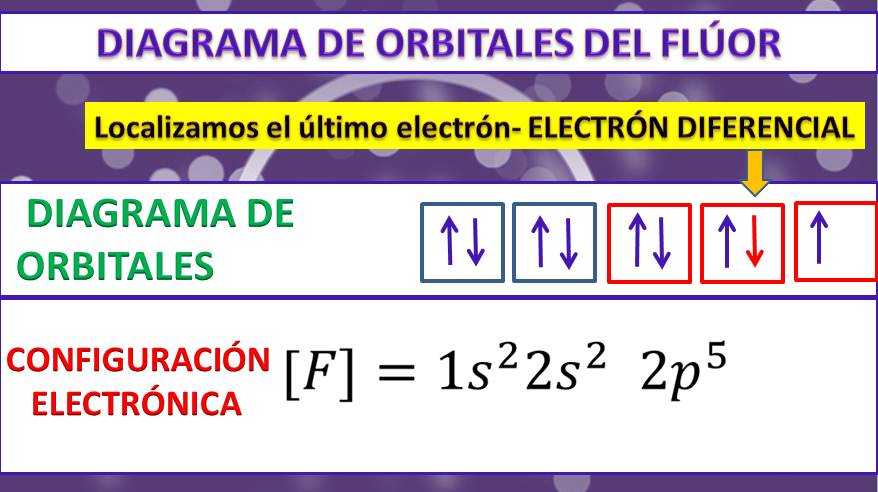
Configuración electrónica: 1s2 2s2 2p5
Configuración abreviada: [He]2s2 2p5
Diagrama de orbitales:
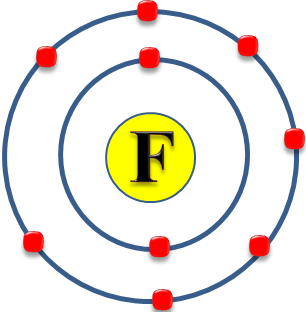
Electrones por capa: 2, 7
Capa de valencia: 2
Electrones de valencia :7
Valencia: 2
Estado de oxidación :-1
Radio atómico (A): 42 pm
Electronegatividad: 4,00
1ºPotencial de ionización (eV) : 17,54
Densidad (g/ml): 1,11
Punto de fusión (º C): -219,6
Punto de ebullición (ºC): -188,2
Video sobre el Flúor :
👉EN ESTE VIDEO «CONFIGURACIÓN ELECTRÓNICA DEL FLÚOR Z=9» te explico como se realiza la configuración electrónica a partir del digrama de Moeller y diagrama de orbitales .Puedes aprender a ubicar un elemento en la tabla periódica y como saber el grupo y periodo del elemento.Así mismo el dibujo del átomo, la capa de valencia y los electrones de valencia.
Configuración abreviada del Flúor
La configuración electrónica abreviada, simplificada o kernel es una forma de acortar la configuración electrónica, tomando como referencia a los gases nobles, a continuación tienes explicada paso a paso la configuración abreviada del flúor
Números cuánticos del flúor
LOS NÚMEROS CUÁNTICOS expresan la situación energética de cada electrón en un átomo y permiten conocer los lugares de máxima probabilidad de encontrar un electrón.
En 1926 Srödinger postuló la ecuación de onda, que le permitió calcular los niveles de energía en el átomo fundando así la mecánica cuántica basada en las partículas subatómicas. Las soluciones de esa ecuación de onda describieron los estados del electrón en el átomo que quedarían plasmados en los tres primeros números cuánticos: n, l y m.
En 1928 tras las investigaciones de Dirac, teniendo en cuenta la teoría de la relatividad se añadiría el cuarto número cuántico, el número cuántico de spin s.
En este video explicamos los números cuanticos del flúor desde de la configuración electrónica y el diagrama de orbitales.
Números cuánticos del flúor
n=2
l=1
m=0
s=-1/2

Para más información sobre los ELEMENTOS QUÍMICOS
