
El aluminio es un elemento químico , de símbolo Al , número atómico 13 y masa atómiva 26,9815 u. Pertenece al grupo de los térreos, o grupo 13 (también llamado III A), en la tabla periódica.El aluminio en estao puro es blando , pero aumenta su resistencia al formar aleaciones con otros elementos.
El aluminio es el elemento metálico más abundante en la tierra, aunque no se encuentra nunca en estado libre, está presente en las plantas y en casi todas las rocas.
Etimología : Del latín aluminium, formado por alúmina ( de alumen, aluminis=lumbre) y el sufijo derivativo «-ium».
Descubridor: Hans Christian Oersted en 1825
Información del aluminio
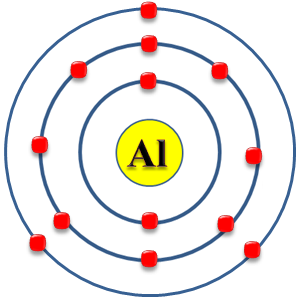
Símbolo: Al
Número atómico: 13
Masa atómica: 26,9815 u
Grupo: 13 o grupo IIIA – Térreos, boroides o boroideos
Periodo: 3
Bloque: p – elementos representativos
Configuración electrónica: 1s2 2s2 2p63s23p1
Configuración abreviada: [Ne]3s23p1
Diagrama de orbitales:

Electrones por capa: 2, 8, 3
Capa de valencia: 3
Electrones de valencia :3
Valencia: 3
Estado de oxidación :+3
Radio atómico (A): 1,43
Electronegatividad: 1,5
1ºPotencial de ionización (eV) : 6,00
Densidad (g/ml): 2,70
Punto de fusión (º C): 660
Punto de ebullición (ºC): 2450
Video sobre el aluminio :
👉EN ESTE VIDEO «CONFIGURACIÓN ELECTRÓNICA DEL ALUMINIO Z=13″ te explico como se realiza la configuración electrónica a partir del digrama de Moeller y diagrama de orbitales .Puedes aprender a ubicar un elemento en la tabla periódica y como saber el grupo y periodo del elemento.Así mismo el dibujo del átomo, la capa de valencia y los electrones de valencia.
Configuración abreviada del aluminio
La configuración electrónica abreviada, simplificada o kernel es una forma de acortar la configuración electrónica, tomando como referencia a los gases nobles, a continuación tienes explicada paso a paso la configuración abreviada del aluminio
Números cuánticos del aluminio
LOS NÚMEROS CUÁNTICOS expresan la situación energética de cada electrón en un átomo y permiten conocer los lugares de máxima probabilidad de encontrar un electrón.
En 1926 Srödinger postuló la ecuación de onda, que le permitió calcular los niveles de energía en el átomo fundando así la mecánica cuántica basada en las partículas subatómicas. Las soluciones de esa ecuación de onda describieron los estados del electrón en el átomo que quedarían plasmados en los tres primeros números cuánticos: n, l y m.
En 1928 tras las investigaciones de Dirac, teniendo en cuenta la teoría de la relatividad se añadiría el cuarto número cuántico, el número cuántico de spin s.
En este video explicamos los números cuánticos del alumnio desde de la configuración electrónica y el diagrama de orbitales.
Números cuánticos del aluminio

Para más información sobre los ELEMENTOS QUÍMICOS
