
El silicio es un elemento químico , de símbolo Si , número atómico 14 y masa atómiva 28,0855 u. Pertenece al grupo de los carbonoideos, o grupo 14 (también llamado IV A), en la tabla periódica. Es un metaloide con propiedades intermedias entre metales y no metales, es quebradizo y tiene lustre. Es un elemento por lo general tetravalente y en algunas es divalente. En su comportamiento químico es netamente electropositivo
Es el segundo elemento más abundante en la corteza terrestre después del oxígeno.
Etimología : del latín cienttífico silicium, derivado de silex (pedernal), una piedra dura, cuya composición química es SiO2
Descubridor: Jons Berzelius en 1823
Información del silicio
Símbolo: Si
Número atómico: 14
Masa atómica: 28,0855 u
Grupo: 14 o grupo IVA – Carbonoideos
Periodo: 3
Bloque: p – elementos representativos
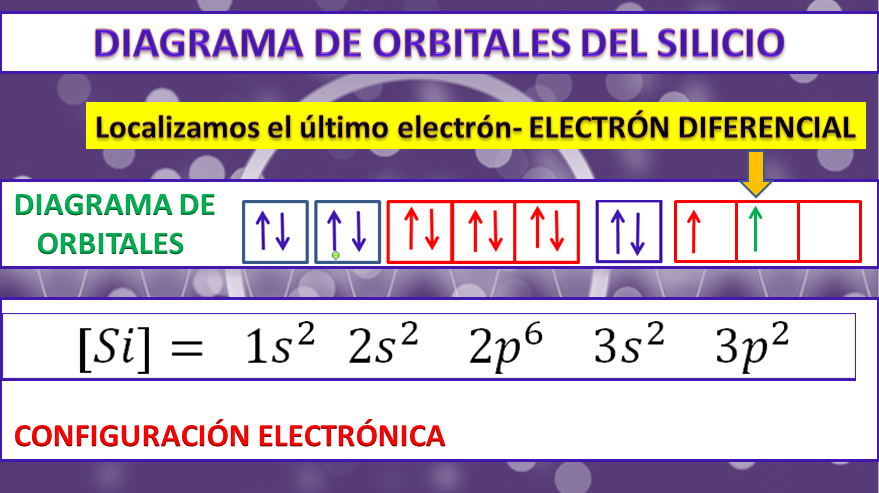
Configuración electrónica: 1s2 2s2 2p63s23p2
Configuración abreviada: [Ne]3s23p2
Diagrama de orbitales:
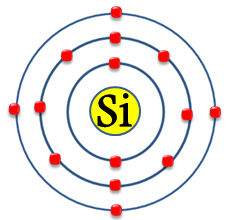
Electrones por capa: 2, 8, 4
Capa de valencia: 3
Electrones de valencia: 4
Valencia: 3
Estado de oxidación :+4
Radio atómico (A): 1,32
Electronegatividad: 1,8
Primer potencial de ionización (eV) : 8,15
Densidad (g/ml): 2,33
Punto de fusión (º C): 1410
Punto de ebullición (ºC): 2680
Video sobre el silicio :
👉EN ESTE VIDEO «CONFIGURACIÓN ELECTRÓNICA DEL SILICIO Z=14» te explico como se realiza la configuración electrónica a partir del digrama de Moeller y diagrama de orbitales .Puedes aprender a ubicar un elemento en la tabla periódica y como saber el grupo y periodo del elemento.Así mismo el dibujo del átomo, la capa de valencia y los electrones de valencia.
Configuración abreviada del silicio
La configuración electrónica abreviada, simplificada o kernel es una forma de acortar la configuración electrónica, tomando como referencia a los gases nobles, a continuación tienes explicada paso a paso la configuración abreviada del silicio
Números cuánticos del silicio
LOS NÚMEROS CUÁNTICOS expresan la situación energética de cada electrón en un átomo y permiten conocer los lugares de máxima probabilidad de encontrar un electrón.
En 1926 Srödinger postuló la ecuación de onda, que le permitió calcular los niveles de energía en el átomo fundando así la mecánica cuántica basada en las partículas subatómicas. Las soluciones de esa ecuación de onda describieron los estados del electrón en el átomo que quedarían plasmados en los tres primeros números cuánticos: n, l y m.
En 1928 tras las investigaciones de Dirac, teniendo en cuenta la teoría de la relatividad se añadiría el cuarto número cuántico, el número cuántico de spin s.
En este video explicamos los números cuánticos del silicio desde de la configuración electrónica y el diagrama de orbitales.
Números cuánticos del silicio
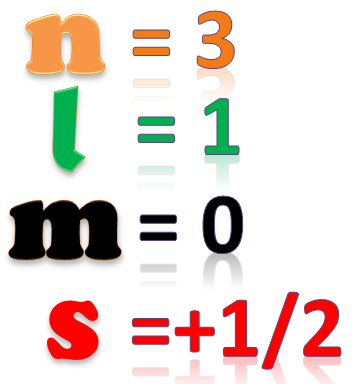
Para más información sobre los ELEMENTOS QUÍMICOS
