Vaporización * Qué es, concepto y definición* Evaporación*Ebullición

En física se denomina cambio de estado a la evolución de la materia entre varios estados de agregación sin que varíe su composición.Los tres estados de agregación más comunes en la Tierra son el líquido, sólido y gaseoso. Por las condiciones existentes en la superficie terrestre, sólo determinadas sustancias pueden encontrarse en los tres estados de agregación, como por ejemplo el agua. La mayoría de las sustancias se presentan en un estado concreto, así los metales suelen estar en estado sólido, el oxígeno en estado gaseoso… En este tema vamos a explicar uno de esos cambios de estado: la vaporización, evaporación y ebullición , de sus diferencias y daremos ejemplos de estos procesos.
| Indice de contenidos 1. Estados de agregación la materia 2. Cambios de estado de agregación 3. Tipos de cambios de estado 4. Vaporización – Ebullición -Evaporación 5. Diferencia entre evaporación y ebullición 6. Ejemplos de vaporización 7.Video explicativo de la fusión con ejemplos |
Estados de agregación la materia
La materia es todo lo que nos rodea y ocupa un espacio. La materia tiene unas propiedades generales, como son masa y volumen y unas propiedades características: densidad, solubilidad, temperatura de fusión, temperatura de ebullición. La materia puede presentarse diferentes estados de agregación
¿Por qué se les llama estados de agregación de la materia? En relación a la disposición de los átomos y las fuerzas de unión que los constituyen, estos átomos se van a agregar unos a otros de manera diferente dependiendo de si son sólidos, líquidos o gases. Además cada estado de la materia tiene unas determinadas características y debido a cambios en el entorno la materia podrá cambiar de estado, viéndose alteradas sus propiedades.
Desde siempre se han conocido tres estados fundamentales de la materia: sólido, líquido y gas. Con el tiempo se han descubierto otros estados : estado plasmático, el Bose-Einstein (BEC), el condensado de Fermi y el supersólido.
Cambios de estado
Se denomina cambio de estado a la modificación en el estado de agregación de la materia sin variar sus propiedades. Son por tanto evoluciones de la materia entre varios estados de agregación, sin que ocurra un cambio en su composición. Es importante tener en cuenta que en las transformaciones en la fase de las sustancias, estas no se sufren cambios químicos ni se transforman en otras, sólo cambia su estado físico.
Trataremos los cambios de estado entre los tres estados clásicos: sólido, líquido y gas. En la siguiente imagen se muestran los diferentes cambios de estado de la materia:
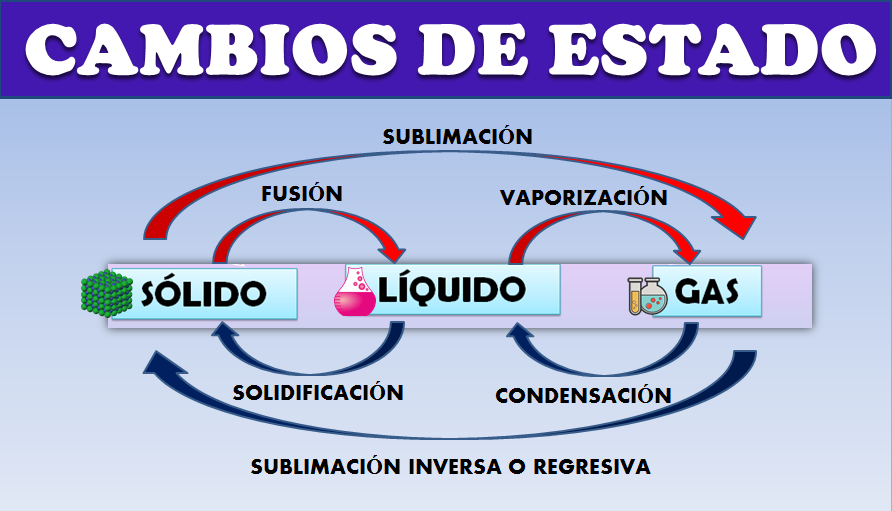
Si en un vaso colocamos un hielo y calentamos, la temperatura aumenta progresivamente y llegaremos a un punto en el que la temperatura permanece constante e invariable y justo en ese momento el hielo empieza a fundirse, en ese momento se está produciendo el cambio de estado de sólido a líquido.
El estado de la materia depende de las fuerzas de cohesión que mantienen unidas a las partículas. La modificación de la temperatura o la presión hará que cambien esas fuerzas y pueden llevarse a cabo los cambios de estado.
Mientras se produce el cambio de estado la temperatura se mantiene constante, ya que en los cambios que requieren aumento de temperatura, la energía se emplea en la ruptura de enlaces y en los cambios que necesitan un enfriamiento, éste produce una reorganización de las partículas.
Tipos de cambio de estado
En un cambio en el estado de agregación la materia cambia su estado físico, manteniendo su composición. Los cambios de estado se clasifican en dos tipos fundamentales:
- Cambios de estado progresivos: son aquellos cambios de estado que requieren un incremento de la energía cinética de las partículas para producirse y necesitarán, por tanto, un aporte externo de energía.
Son cambios progresivos : la fusión, vaporización y sublimación progresiva.
- Cambios de estado regresivos: son aquellos cambios de estado que necesitan un descenso en la energía cinética de las partículas (las partículas comienzan a agregarse unas a otras al moverse más despacio) .Estas transformaciones liberan o desprenden energía al producirse.
Son cambios regresivos: la condensación, solidificación y sublimación inversa.
Vaporización
Es un proceso físico en el que se produce el paso de líquido a gas. Se trata de un proceso endotérmico (absorbe energía) que necesita un aporte de calor. Ejemplo: paso de agua líquida al estado de vapor…

La vaporización es un fenómeno que puede ocurrir de dos formas:
- Ebullición: el proceso de ebullición consiste en el paso de la fase líquida a la fase gaseosa aportando calor. Cuando calentamos un líquido , en este proceso de calentamiento, llega un momento en que la temperatura deja de elevarse y permanece constante, esa es la temperatura de ebullición, que es la temperatura a la que se produce el cambio de estado. La energía suministrada en vez de seguir elevando la temperatura, se emplea en que las partículas venzan las fuerzas de atracción y empiecen a escapar al estado gaseoso. Este proceso ocurre por ejemplo al hervir agua, donde las partículas escapan y se transforman en vapor y progresivamente disminuye el nivel de agua en el recipiente. ¿Qué es el punto de ebullición ? es la temperatura a la cual un líquido comienza a hervir y pasa al estado gaseoso. Es característico de cada sustancia.

- Evaporación: es el paso de líquido a gas y ocurre cuando un líquido se evapora de manera natural sin necesidad de aportar calor o cambiar sus condiciones.El modelo cinético de la materia indica que hay partículas que en la superficie del líquido alcanzan la energía suficiente y escapan. Por ejemplo: la ropa tendida húmeda, el agua se evapora y las partículas empiezan a pasar a vapor.

Diferencias entre evaporación y ebullición
La vaporización es el proceso por el que un líquido pasa al estado gaseoso. La evaporación y la ebullición son dos tipos de vaporización.
¿En que se diferencian ebullición y evaporación? La ebullición es un proceso que ocurre en toda la masa del líquido y la evaporación se produce únicamente en la superficie del líquido. En la siguiente tabla puedes ver sus diferencias:
| EVAPORACIÓN | EBULLICIÓN |
| -Paso de gas a líquido a gas de manera natural | -Paso de líquido a gas al aumentar la temperatura hasta el punto de ebullición |
| -Ocurre en la superficie del líquido | – Sucede en toda la masa del líquido |
| -Proceso más lento , de manera gradual con el tiempo | -Se produce rápidamente una vez alcanzada la temperatura |
| -Se produce a cualquier temperatura | -Sólo se produce a una determinada temperatura, característica de cada sustancia |
Ejemplos de vaporización
- Hervir agua. Al llevar el agua a 100 º C (punto de ebullición del agua) sus partículas comienzan a agitarse y adquieren la energía suficiente para pasar a vapor.
- Secado de ropa tendida . Cuando se lava la ropa y se tiende, por el proceso de evaporación se queda seca. La evaporación se produce en la superficie, por eso las telas se extienden para facilitar el secado. Los factores que afectan al secado son : el calor ( la evaporación se acelera con el calor) y la humedad que haya en el aire.
- Humedad atmosférica. La humedad que hay en la atmósfera es fruto de la vaporización. Ese es el motivo por el que en zonas cercanas al mar la humedad atmosférica es mayor.
- Las nubes. Son producto de la vaporización del agua (mares, lagos, lagunas…) en el ciclo del agua y de otras superficies húmedas (plantas, animales…) que se condensan en forma de gotas en la atmósfera formando las nubes.
- Las salinas. El proceso de obtención de sal marina dejando evaporar el agua salado en las salinas se produce por evaporación eliminándose el agua, quedando la sal cristalizada.
- Alcohol y éter. Son dos líquidos muy volátiles y a temperatura ambiente se evaporan rápidamente.
- Vapor en bebidas calientes. Si tomamos té y café por ejemplo, observamos que sale vapor sobre la taza, pasando parte de la bebida al estado gaseoso. Esto es debido a que el proceso de vaporización se produce debido al calor de la bebida.
- Secado de suelo húmedo. Las baldosas del suelo no absorben el líquido al fregarlo, pero cuando se limpia una superficie (suelo, azulejos..) observamos que está seca cuando pasa un tiempo. Eso es debido a que el agua pasa al estado gaseoso debido a la vaporización
Video explicativo de la vaporización, evaporación y ebullición con ejemplos
A continuación puedes ver un video sobre un cambios de estado, la vaporización, donde explicamos diferencias entre evaporación y ebullición y ejemplos de estos procesos de cambio de estado.
