¿Qué son los cambios de estado?
En física se denomina cambio de estado a la evolución de la materia entre varios estados de agregación sin que varíe su composición.Los tres estados de agregación más comunes en la Tierra son el líquido, sólido y gaseoso.
Por las condiciones existentes en la superficie terrestre, sólo determinadas sustancias pueden encontrarse en los tres estados de agregación, como por ejemplo el agua. La mayoría de las sustancias se presentan en un estado concreto, así los metales suelen estar en estado sólido, el oxígeno en estado gaseoso… En este tema vamos a ver los principales cambios de estado de la materia y cómo se producen.
Estados de agregación la materia
La materia es todo lo que nos rodea y ocupa un espacio. La materia tiene unas propiedades generales, como son masa y volumen y unas propiedades características: densidad, solubilidad, temperatura de fusión, temperatura de ebullición.

En el siguiente video puedes ver los tres estados de la materia y sus características:
Desde siempre se han conocido tres estados fundamentales de la materia o estados de agregación de la materia: sólido, líquido y gas. Con el tiempo se han descubierto otros estados : estado plasmático, el Bose-Einstein (BEC), el condensado de Fermi y el supersólido
¿Por qué se les llama estados de agregación de la materia? En relación a la disposición de los átomos y las fuerzas de unión que los constituyen, estos átomos se van a agregar unos a otros de manera diferente dependiendo de si son sólidos, líquidos o gases. Además cada estado de la materia tiene unas determinadas características y debido a cambios en el entorno la materia podrá cambiar de estado, viéndose alteradas sus propiedades.
A continuación explicamos las principales propiedades de estos estados:
Estado sólido
El estado sólido es aquel en el que observamos materia fija, .tienen forma y volumen constante. Se caracterizan por una estructura compacta y su rigidez .Por ejemplo: las rocas, metales…

Estado líquido
El estado líquido corresponde a los fluidos. En el estado líquido las fuerzas de cohesión que unen átomos y moléculas son menoresque en los sólidos , por lo que la masa es fija pero su forma es variable; así los líquidos pueden adaptarse al recipiente que los contiene. De esta forma su volumen es constante pero su forma no lo es, además pueden fluir y no son compresibles. Por ejemplo: el agua, el aceite, los zumos..

Estado gaseoso
La materia en estado gaseoso tiene una masa fija pero hay grandes espacios vacíos entre los átomos, de manera que los gases tienen forma y volumen variables, aunque su masa es fija, no tienen forma ni volumen constante. Es muy característico en ellos la variación de volumen, adaptándose al recipiente que los contiene cuando cambian condiciones de presión y temperatura Por ejemplo: vapor de agua, oxígeno (O2 ) dióxido de carbono (CO2)

Propiedades de los tres estados: sólido, líquido y gas
Cambios de estado
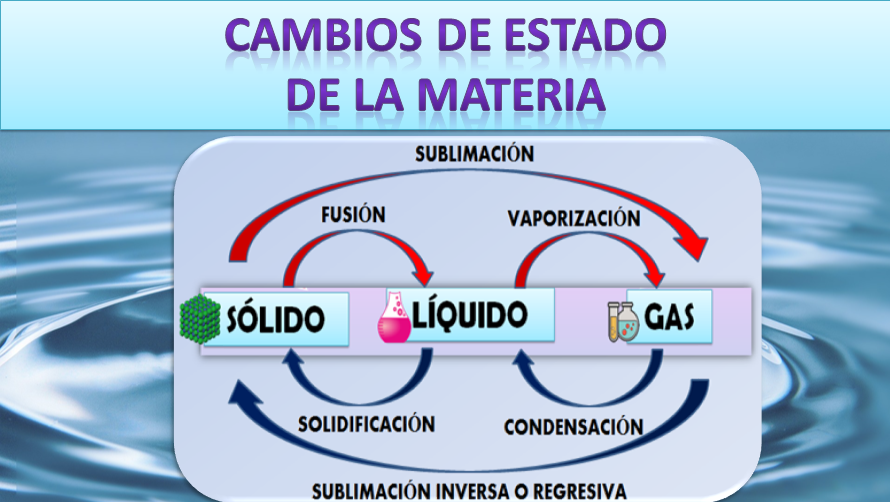
Se denomina cambio de estado a la modificación en el estado de agregación de la materia sin variar sus propiedades. Son por tanto evoluciones de la materia entre varios estados de agregación, sin que ocurra un cambio en su composición. Es importante tener en cuenta que en las transformaciones en la fase de las sustancias, estas no se sufren cambios químicos ni se transforman en otras, sólo cambia su estado físico. Trataremos los cambios de estado entre los tres estados clásicos: sólido, líquido y gas. En la siguiente imagen se muestran los diferentes cambios de estado de la materia:
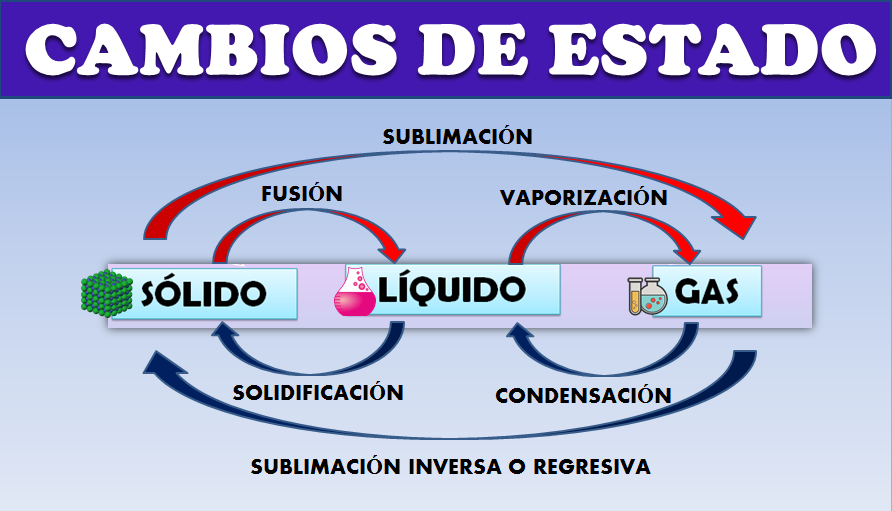
Si en un vaso colocamos un hielo y calentamos, la temperatura aumenta progresivamente y llegaremos a un punto en el que la temperatura permanece constante e invariable y justo en ese momento el hielo empieza a fundirse, en ese momento se está produciendo el cambio de estado de sólido a líquido.
Los cambios de estado se producen al modificar la temperatura (aumentando o disminuyendo) y/o la presión. Según la teoría cinético-molecular al aumentar la temperatura de una sustancia aumenta la energía cinética de sus partículas, por lo que adquieren mayor movilidad y se vencen las fuerzas de cohesión:
-En los sólidos la vibración ocurre con violencia y origina una ruptura de la estructura.
-En los líquidos el aumento de temperatura ocasiona una mayor velocidad de las particular permitiendo que puedan escapar al aire.
Mientras se produce el cambio de estado la temperatura se mantiene constante, ya que en los cambios que requieren aumento de temperatura, la energía se emplea en la ruptura de enlaces y en los cambios que necesitan un enfriamiento, éste produce una reorganización de las partículas.
Tipos de cambio de estado
Hay dos tipos fundamentales de cambios de estado
–Cambios de estado progresivos: fusión, vaporización y sublimación progresiva.
–Cambios de estado regresivos: condensación, solidificación y sublimación inversa.
Fusión
La fusión es el paso de materia sólida a materia líquida al aumentar la temperatura de un sólido hasta su punto de fusión. Se trata de un proceso endotérmico (absorbe energía) que necesita un aporte de calor. Ejemplo: derretir mantequilla, fundir chocolate, derretir helados…
Cuando calentamos un sólido, en este proceso de calentamiento, llega un momento en que la temperatura deja de elevarse y permanece constante, esa es la temperatura de fusión, que es la temperatura a la que se produce el cambio de estado.

Vaporización
La vaporización es un proceso físico en el que se produce el paso de líquido a gas. Se trata de un proceso endotérmico (absorbe energía) que necesita un aporte de calor. Ejemplo: paso de agua líquida al estado de vapor…
La vaporización es un fenómeno que puede ocurrir de dos formas:
- Ebullición: el proceso de ebullición consiste en el paso de la fase líquida a la fase gaseosa aportando calor. Cuando calentamos un líquido , en este proceso de calentamiento, llega un momento en que la temperatura deja de elevarse y permanece constante, esa es la temperatura de ebullición,
- Evaporación: es el paso de líquido a gas y ocurre cuando un líquido se evapora de manera natural sin necesidad de aportar calor o cambiar sus condiciones

Sublimación
La sublimación es el paso del estado de sólido a gaseoso sin pasar por el estado líquido. Este proceso ocurre cuando las moléculas que componen el sólido adquieren la energía suficiente para vencer las fuerzas de atracción que las mantienen unidas entre ellas y logran escapar al estado gaseoso.
La palabra sublimación procede de la palabra sublimatio, que se traduce como “elevación”, del verbo latino sublimare “enaltercer o elevar”.
Ejemplo de sublimación es el hielo seco . A temperatura ambiente, el hielo elaborado con dióxido de carbono, comprimido y congelado recupera su forma gaseosa original. En el planeta Marte se encuentra en estado natural y sublima cuando la superficie le llega la luz solar durante la primavera.

Condensación
La condensación es el cambio de estado de la materia en estado gaseoso a forma líquida, tras perder energía calórica. Se trata de un cambio físico, por lo que las sustancias no sufren transformaciones químicas.
Si la temperatura de un gas está por debajo de su punto de ebullición, las partículas comienzan a moverse más lentamente y a agregarse unas a otras. Esto ocurre al bajar la temperatura y/ o subir la presión, en ese momento las particular pierden movilidad y pasan al estado líquido. El gas libera calor retenido y se deposita en formad de pequeñas gotas
De esta forma vemos como el proceso de condensación forma parte del ciclo del agua, tras la evaporación ,el vapor del agua se eleva, se enfría y condensa y por acumulación, de esta forma, las gotas de agua forman las nubes. Así mismo la niebla o neblina es otro caso de condensación, ya que el vapor de agua se acumula y permanece en suspensión sobre la superficie terrestre como nubes bajas . Si esto ocurre en la superficie del mar se conoce como bruma.

Solidificación
La solidificación es un proceso físico en el que se produce el cambio de estado en una materia que pasa de líquido a sólido. Este proceso se desarrolla debido a una disminución de la temperatura y la energía. Al descender la temperatura de un fluido, las partículas se van aproximando unas a otras y se reduce su movilidad, por lo que se van agregando unas a otras formando la estructura sólida compacta. Esta aproximación de las partículas y la falta de movilidad le da la firmeza para solidificarse.
En líneas generales, todo compuesto que pasa por este proceso de solidificación disminuye de volumen, pasando a ocupar menor espacio. No obstante, el agua es una excepción, ya que el volumen del hielo es mayor que el del agua líquida.
Punto o temperatura de solidificación. Todas las sustancias en la naturaleza tienen su propio punto o temperatura de solidificación determinado, llegando a ese punto dicha sustancia cambiará de estado y pasará de ser líquido a sólido. Por ejemplo, el punto o temperatura de solidificación del agua, es decir el punto en el que pasa de líquido a sólido es exactamente de 0 ℃, temperatura que está directamente relacionada con la densidad del agua, y será importante a la hora de conocer que modificaciones en presión y temperatura necesitará un determinado volumen de agua para cambiar de estado líquido a sólido.

Sublimación inversa o regresiva
Conocida como desublimación, sublimación inversa, sublimación regresiva o deposición, es un fenómeno mediante el cual la materia en estado gaseoso pasa al estado sólido, sin pasar primero por el estado líquido. En este proceso, las partículas gaseosas al enfriarse pierden energía cinética y se van agregando unas a otras y ordenando hasta conseguir el estado sólido. El resultado final de este proceso es la formación de una capa de cristal sólido sobre la superficie.
Es un proceso exotérmico, que libera energía y se produce por bajas temperaturas y a determinadas condiciones de presión. Es el proceso inverso a la sublimación.
La palabra “deposición” con que también se conoce este fenómeno quiere decir que la partícula se deposita desde la fase gaseosa sin mojar la superficie receptora, por eso este proceso de sublimación inversa se encuentra a menudo sobre objetos gélidos
La sublimación, sea inversa o regresiva es un fenómeno de la naturaleza al cual puede ser sometida cualquier sustancia pura, pero bajo unas determinadas condiciones, por eso no suele observarse a menudo como un proceso natural, sólo en el laboratorio y en algunos paisajes específicos, como la alta montaña nevada o los polos.

