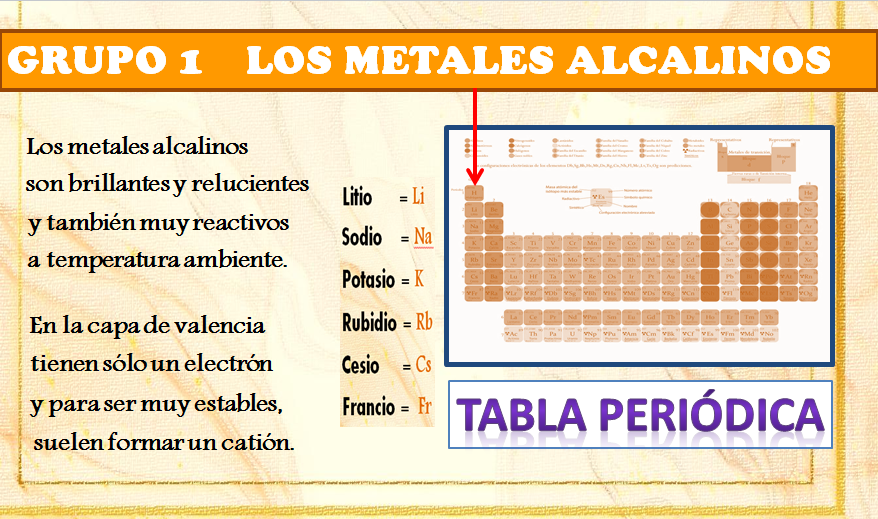
El grupo de los metales alcalinos o «alcalinos» (del árabe alqali) está formado por estos seis elementos : litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr).
Pertenecen al grupo 1 (IA) de la Tabla Periódica. Son brillantes ,relucientes y muy reactivos en condiciones normales de presión y temperatura. No se encuentran en estado puro en la naturaleza. Tienen bajos puntos de fusión y ebullición. Son buenos conductores del calor y la electricidad y tienen baja densidad.
| Indice del contenido 1-Características de los alcalinos 2-Aprende los alcalinos en un minuto 3-Configuración electrónica de los metales alcalinos 4-Obtención de los metales alcalinos 5-Uso y características de los alcalinos 6-Elementos químicos de la Tabla Periódica |
¿Qué son los alcalinos?
Los metales alcalinos son un grupo de elementos que están en el grupo 1 de la tabla Periódica y son elementos químicamente activos. Son metales blandos, poseen baja densidad y son muy reactivos. Suelen encontrarse combinados en otros elementos formando sales y para obtenerlos se requieren determinados procedimientos por no encontrarse libres en la naturaleza. Es necesario almacenarlos en aceite para evitar que reaccionen con la humedad del aire.
Todos ellos, por pertenecer al grupo 1 de la Tabla Periódica, tienen un electrón en la última capa, su nivel más externo, la llamada capa de valencia.Tienen tendencia a perder ese electrón y formar iones positivos o cationes.
Su carácter metálico es alto, pero por el contrario tienen baja afinidad electrónica, potencial de ionización y electronegatividad.
A continuación puedes ver el siguiente video resumen sobre los alcalinos, sus características, propiedades, configuración electrónica y cada uno de los elementosde una forma rápida y muy fácil los metales alcalinos
Aprende los alcalinos en 1 minuto
Para aprender de una forma muy sencilla los metales alcalinos con una frase en este video short : aprende los alcalinos en un minuto
Configuración electrónica de los metales alcalinos
La configuración electrónica es la representación gráfica de la distribución de los electrones en un átomo en los distintos niveles y subniveles de energía. La hacemos por medio del diagrama de Möeller. En el siguiente video explicamos como es la configuración electrónica de los metales alcalinos
Obtención de los metales alcalinos
Los metales alcalinos, como hemos dicho anteriormente, no existen en estado libre en la naturaleza, sino que se obtienen por electrolisis de sales.
Por ejemplo el sodio metálico se obtiene a través del cloruro sódico fundido, por medio del método de Down. El proceso se realiza en una celda a la que se le da el nombre de «downs», donde se agregan pequeñas cantidades de cloruro de calcio para reducir el punto de fusión del cloruro.
Uso y características de los alcalinos
Litio (Li)
El litio es un elemento químico de símbolo Li y número atómico 3. Pertenece al grupo 1 o grupo IA y es uno de los metales Alcalinos.
En estado puro es un metal blando de color blanco plata y es el elemento sólido más ligero. Ver más Información litio
Usos: se utiliza para producir vidrios, como componente de pilas, baterías, lubricantes y para esmaltar cerámica. ´También se usa para la síntesis de aluminio de gran resistencia.
Sodio (Na)
El sodio es un elemento químico de número atómico 11 y símbolo Na, que pertenece al grupo de los metales alcalinos, o grupo 1, en la tabla periódica
Es un elemento tóxico , pero fundamental componente en las células. Ver más información sodio
Usos: por su potencial blanqueador es muy utilizado en la industria textil. Aparece como componente de jabones y de algunas gasolinas. Se utiliza en lámparas de vapor de sodio ypara la refrigeración en reactores nucleares.
Potasio (K)
El potasio es un elemento químico de número atómico 19
Ver más información potasio
Elementos químicos de la tabla periódica
Los elementos químicos están recogidos y clasificados en la tabla periódica, por orden creciente de número atómico y de acuerdo a su configuración electrónica y propiedades químicas.

A continuación se detallan los elementos químicos, ordenados por su número atómico. Si quieres ver los datos de cada elemento, pincha sobre él en la siguiente tabla.
| Número atómico | Elemento | Simbolo | Grupo | Periodo |
| 1 | Hidrógeno | H | 1 -Alcalinos | 1 |
| 2 | Helio | He | 18- Gases nobles | 1 |
| 3 | Litio | Li | 1-Alcalinos | 2 |
| 4 | Berilio | Be | 2-Alcalinotérreos | 2 |
| 5 | Boro | B | 13-Térreos | 2 |
| 6 | Carbono | C | 14-Carbonoidéos | 2 |
| 7 | Nitrógeno | N | 15-Nitrogenoideos | 2 |
| 8 | Oxígeno | O | 16-Anfígenos | 2 |
| 9 | Flúor | F | 17-Halógenos | 2 |
| 10 | Neón | Ne | 18-Gases nobles | 2 |
| 11 | Sodio | Na | 1-Alcalinos | 3 |
| 12 | Magnesio | Mg | 2-Alcalinoterreos | 3 |
| 13 | Aluminio | Al | 13-Térreos o boroides | 3 |
| 14 | Silicio | Si | 14-Carbonoideos | 3 |
| 15 | Fósforo | P | 15-Nitrogenoideos | 3 |
| 16 | Azufre | S | 16-Anfígenos | 3 |
| 17 | Cloro | Cl | 17-Halógenos | 3 |
| 18 | Argón | Ar | 18-Gases nobles | 3 |
| 19 | Potasio | K | 1-Alcalinos | 4 |
Electrones de valencia :6
Valencia: 2
Estado de oxidación :-2
Radio atómico (A): 0,65
Electronegatividad: 3;5
1ºPotencial de ionización (eV) : 13,70
Densidad (g/ml): 1,429
Punto de fusión (º C): -218,8
Punto de ebullición (ºC): -183
Configuración electrónica oxígeno
Configuración abreviada oxígeno
La configuración electrónica abreviada, simplificada o kernel es una forma de acortar la configuración electrónica, tomando como referencia a los gases nobles, a continuación tienes explicada paso a paso la configuración abreviada del oxígeno.
Números cuánticos del oxígeno
LOS NÚMEROS CUÁNTICOS expresan la situación energética de cada electrón en un átomo y permiten conocer los lugares de máxima probabilidad de encontrar un electrón.
En 1926 Srödinger postuló la ecuación de onda, que le permitió calcular los niveles de energía en el átomo fundando así la mecánica cuántica basada en las partículas subatómicas. Las soluciones de esa ecuación de onda describieron los estados del electrón en el átomo que quedarían plasmados en los tres primeros números cuánticos: n, l y m.
En 1928 tras las investigaciones de Dirac, teniendo en cuenta la teoría de la relatividad se añadiría el cuarto número cuántico, el número cuántico de spin s.
En este video explicamos los números cuánticos del oxígeno desde de la configuración electrónica y el diagrama de orbitales.
Números cuánticos del oxígeno
n=2
l=1
m=-1
s=-1/2
Para más información sobre los ELEMENTOS QUÍMICOS
